Research Abstract
電位依存性H+チャネルHv1では細胞質のコイルドコイル領域が協調したゲーティングの温度感受性にかかわっている
The cytoplasmic coiled-coil mediates cooperative gating temperature sensitivity in the foltage-gated H+ channel Hv1
2012年5月8日 Nature Communications 3 : 816 doi: 10.1038/ncomms1823
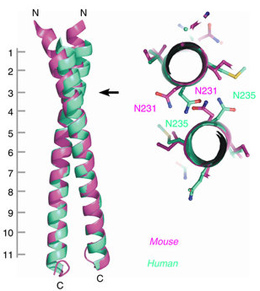
Hv1/VSOPは二量体として機能する電位依存性H+チャネルで、1つのサブユニットのゲーティングが、二量体中のもう1つのサブユニットのゲーティングと共役していることが報告されている。しかし、二量体形成およびサブユニット間の共役の分子基盤はまだ解明されていない。本論文では、S4電位センサーへリックスの下流にあるカルボキシ末端がより合わさって二量体のコイルドコイル構造を作り、これによって協調したゲーティングが起こることを示す。また、Hv1/VSOPを通るH+電流の温度に依存した活性化はコイルドコイルドメインの熱安定性によって調節されており、この調節はS4とコイルドコイル領域間をつなぐリンカーの変異によって変化することもわかった。二量体で見られる協調したゲーティングもリンカーの構造に依存しており、円偏光二色性スペクトル解析からリンカーはαへリックスと考えられる。今回の結果は、細胞質内のコイルドコイル領域が、S4とつながったαへリックスを形成して協調したゲーティングを実現し、実際の温度範囲に見合うように適度な調整を行っていることを示している。
- 大阪大学大学院医学系研究科 総合生理学教室
- 大阪大学蛋白質研究所
- 大阪大学大学院 生命機能研究科
Hv1/VSOP is a dimeric voltage-gated H+ channel in which the gating of one subunit is reportedly coupled to that of the other subunit within the dimer. The molecular basis for dimer formation and intersubunit coupling, however, remains unknown. Here we show that the carboxy terminus ends downstream of the S4 voltage-sensor helix twist in a dimer coiled-coil architecture, which mediates cooperative gating. We also show that the temperature-dependent activation of H+ current through Hv1/VSOP is regulated by thermostability of the coiled-coil domain, and that this regulation is altered by mutation of the linker between S4 and the coiled-coil. Cooperative gating within the dimer is also dependent on the linker structure, which circular dichroism spectrum analysis suggests is α-helical. Our results indicate that the cytoplasmic coiled-coil strands form continuous α-helices with S4 and mediate cooperative gating to adjust the range of temperatures over which Hv1/VSOP operates.

