شخصيات العام من نيتشر: عشرة أسماء رسمت ملامح المشهد العلمي في 2025
29 December 2025
هل حلقات الحمض النووي الريبي هي القفزة القادمة في صناعة الأدوية؟
نشرت بتاريخ 21 نوفمبر 2023
كان للنجاح التجاري الكبير الذي حققته لقاحات الحمض النووي الريبي في مجابهة جائحة «كوفيد-19» أكبر الأثر في إنعاش الآمال في أن يكون الحمض النووي الريبي الدائري هو الأساس الذي يتكئ عليه الجيل القادم من العلاجات.
أثبتت لقاحات الحمض النووي الريبي (RNA) أنها الحصان الأسود خلال جائحة «كوفيد-19». ما شهدناه خلال سنوات الجائحة يؤهل عملية طرح هذه اللقاحات لأن تكون الأكبر والأعلى مردودًا على مرِّ التاريخ، فضلًا عن أنه قد أهَّلها بالفعل لحصد جائزة نوبل في الطب أو الفسيولوجيا لهذا العام. لكن كان معروفًا من البداية، ومنذ وقتٍ طويل، أن هذه التقنية يعيبها قصورٌ أساسي: وهو أن الحمض النووي الريبي، في صورته الخطية المعتادة، قصير الأجل. ففي غضون ساعات، تنهال الإنزيمات على جزيء الحمض النووي الريبي، وتمزقه كل ممزَّق.
على أن هذه الطبيعة المتطايرة للحمض النووي الريبي ليست بالعائق الكبير أمام تطوير لقاح؛ وذلك لأن هذه العملية لا تتطلَّب سوى تشفير البروتينات لمدة قصيرة، ريثما تحفز انطلاق الاستجابة المناعية. أما بالنسبة إلى غالبية الأغراض العلاجية، فمن المحبَّذ جدًا الحصول على حمض نووي ريبي بإمكانه البقاء فترةً أطول.
وهنا تبرُز أهمية الأحماض النووية الدائرية أو الحلَقية؛ ذلك أنك إذا ربطتَ طرفَي نسخة الحمض النووي الريبي، فإن كثيرًا من الإنزيمات الهاضمة لهذا الحمض لا تجد شيئًا تغرس فيه أسنانها. عندما يأخذ الحمض النووي الريبي شكل الحلقة، يكون أكثر استقرارًا وأطول عمرًا، على النحو الذي يزيد – نظريًا – من فُرص استغلاله للأغراض العلاجية، حتى ولو بجرعات قليلة.
يقول هوارد تشانج، عالم الجينات الجزيئية بكلية طب جامعة ستانفورد في ولاية كاليفورنيا الأمريكية: "بجرعة واحدة، يمكنك تفعيل عملية إنتاج البروتينات لفترة ممتدة". شارك تشانج في تأسيس شركة «أوربيتال ثيرابيوتكس» Orbital Therapeutics في مدينة كامبريدج، بولاية ماساتشوستس، وهي واحدة من عشر شركات، أو أكثر، من شركات التكنولوجيا الحيوية، تعكف حاليًا على تطوير علاجات قائمة على الحمض النووي الريبي الحلقي المعدَّل.
على مدار السنوات الثلاث الماضية، تحصَّلت هذه الشركات مجتمعةً على رأس مال استثماري يتجاوز مليار دولار أمريكي. وفي الأثناء، يُلاحَظ أن كثيرًا من شركات الأدوية الكبرى قد شرعت في جسّ نبض هذه التقنية كذلك. تنطلق هذه الشركات من الاعتقاد بأنه إذا كان الحمض النووي الريبي الخطي قادرًا على فعل شيء، فإنه في صورته الحلقية قادر على فعل الشيء نفسه بشكل أفضل.
يتوقع أنصار هذه التقنية والمتحمِّسون لها أن يرسِّخ الحمض النووي الريبي الدائري مكانته بوصفه المنصَّة المفضَّلة، من بين المنصَّات القائمة على الحمض النووي الريبي، في صناعة الأدوية. ويتوسَّمون في هذه التقنية أن تفضي بنا في نهاية المطاف إلى تطبيقات ومنتجات عدَّة: من اللقاحات المتطورة وعلاجات الأمراض النادرة، إلى المواد الفعَّالة في علاج السرطان، وغيرها. وقد انطلقت في شهر أغسطس الماضي أولى التجارب البشرية لهذه الأدوية.
غير أن طريقًا طويلًا ينتظر تقنيات الحمض النووي الريبي الدائري قبل أن يتسنَّى لها إحداث الثورة المنشودة، أو تحقيق هدف إطلاق مئة برنامج دوائي، الذي تنبَّأت شركة ناشئة بأن يتحقق بحلول نهاية العقد الجاري (انظر: go.nature.com/3pwbkjx). أما ما إذا كانت هذه القدرة الإضافية على التحمُّل، التي يتمتع بها الحمض النووي الريبي الدائري، من شأنها أن تمكِّنه من التفوق على منافسيه من الطرق العلاجية القائمة بالفعل – مثل العلاجات الجينية التقليدية، أو تقنيات التعديل الجيني المستحدَثة – فهذه مسألة لا تزال مطروحة على طاولة البحث.
يقول جايك بيكرافت، الذي شارك في تأسيس شركة البيولوجيا التخليقية «ستراند ثيرابيوتكس» Strand Therapeutics في مدينة بوسطن بولاية ماساتشوستس، ويرأس مجلس إدارتها، وهي من الشركات التي تُدخل الحمض النووي الريبي الدائري في برامجها الدوائية – يقول: "أرجو ألا تسيء فهمي: إنني أعتقد أن الحمض النووي الريبي الدائري هو الشيء الذي نبحث عنه حقًا، لكن هناك الكثير جدًا من التحديات التي يتمُّ إغفالها أو التغاضي عنها تمامًا".
فكرة دائرية
اكتشافُ الحمض النووي الريبي الدائري لأول مرة كان في الطبيعة عام 1976، حين أفاد فريق ألماني من الباحثين بعثوره في النباتات على سلسلة من مُمرضات الحمض النووي الريبي الدقيقة، والشبيهة بالفيروسات، تتخذ شكلًا دائريًّا1. وبعد 15 عامًا، أمكن التعرُّف على الجزيئات نفسها في خلايا الإنسان وغيره من الثدييات2.
إلا أن الأمر قد استغرق من الباحثين سنوات عدَّة، إلى ما بعد عام 2010، حتى تنبَّهوا إلى حجم جزيئات الحمض النووي الريبي حلقية الشكل في الخلايا على اختلاف أنواعها، واكتشفوا الأدوار المتعددة التي تؤديها هذه الجزيئات في توجيه دفَّة النشاط البيولوجي.
فإذا كان دورها الرئيس يتمثل في الامتثال للجزيئات التنظيمية للتوسُّط في عملية التعبير الجيني، فإن لها أدوارًا أخرى كذلك، إذ بإمكانها تشفير البروتينات؛ وهي الوظيفة التي سرعان ما فطن العلماء إلى أنها ربما تحمل إمكانات علاجية، شريطة أن يجدوا سبيلًا لتخليق حلقات الحمض النووي الريبي من الصفر.
تنشأ هذه الدوائر في الخلايا من خلال نمط غير تقليدي من أنماط معالجة الحمض النووي الريبي المرسال (mRNA)، يُشار إليه بنمط «التضفير الخلفي» (back-splicing). عادة ما تتمُّ عملية تضفير الحمض النووي الريبي بطريقة أشبه ما تكون بالمونتاج السينمائي؛ حيث تُقصُّ الأجزاء غير المسؤولة عن التشفير، وتُضمُّ بقية الأجزاء بلصقها معًا. لكن في بعض الحالات، يسلك الحمض النووي الريبي مسلكًا مغايرًا وغير متوقع، إذ ينطوي على نفسه مرة أخرى، وينضغط مشكِّلًا حلقة مستقلة.
يتطلب التضفير الخلفي تنسيقًا معقدًا بين البروتينات المختلفة، وكلها موجودة بشكل طبيعي داخل الخلايا، لكن تحضيرها على طاولات المختبرات ليس بالأمر اليسير. ومن هنا، عمد الباحثون في أوائل التسعينيات إلى ابتكار حلين محتملين لتحضير حلقات حمض نووي ريبي مخلَّقة.
يقوم الحل الأول على الاستعانة بوصلات الحمض النووي (DNA) لربط طرفي شريط الحمض النووي الريبي (RNA) معًا، بينما يقوم إنزيم آخر بإحكام الربط، في عملية يُطلق عليها «اللحام» (ligation)3. أما الحل الآخر فيقوم على الاستفادة من الخصائص الأنزيمية لتسلسلات الحمض النووي الريبي (RNA) المتخصصة نفسها4،5. عندما يتزاوج اثنان من هذه التسلسلات، في شكلٍ يشبه دبوس الشعر، يمكنهما البدء في تفاعلات ربط متقاطع فيما بينهما، لتتشكَّل منهما حلقة (انظر: حلقات الحمض النووي الريبي).
Source: Adapted from L. Santer et al. Mol. Ther. 27, 1350–1363 (2019)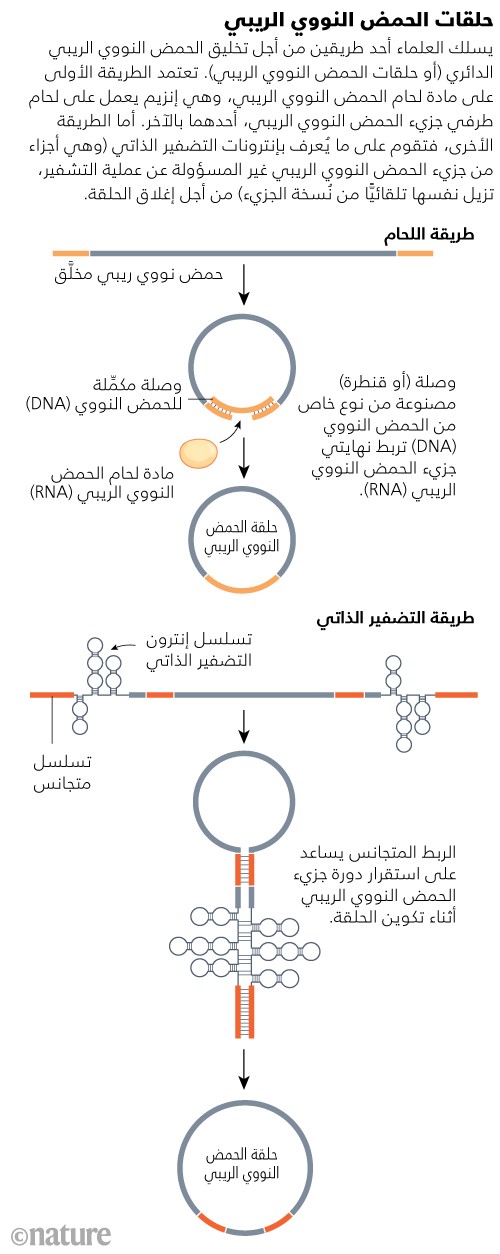
في عام 1995، توصلت مجموعة بحثية من جامعة كولورادو بمدينة دنفر الأمريكية إلى طريقة إنتاج البروتينات من هذه الحلقات المخلَّقة مخبريًّا، باستخدام تسلسل متخصص، يسمى موقع دخول الريبوسوم الداخلي، ويُشار إليه بالاسم المختصر: IRES66. يتيح هذا التسلسل للريبوسوم، الذي يُعد ماكينة إنتاج البروتينات في الخلية، الارتباط بنسخة من الحمض النووي الريبي الحلقي، والبدء في إنتاج البروتينات بشكل مستمر. تقول جريس تشين، عالمة البيولوجيا المتخصصة في دراسة الحمض النووي الريبي في كلية الطب بجامعة ييل، في مدينة نيو هيفن بولاية كونيتيكت: "لا يحتاج الريبوسوم إلى الانفصال قط".
على أن الباحثين لم يُفلحوا بوجه عام سوى في تخليق تسلسلات دائرية قصيرة، لا تزيد على بضع مئات من النيوكليوتيدات. وعلى مدى السنوات العشرين التالية، ظل التطور في هذا المجال متوقفًا بسبب عائق الحجم، مما جعل من المستحيل توليد نُسخ لتشفير البروتينات من الطول بحيث تسمح بعلاج أمراض مثل التليف الكيسي، أو الهيموفيليا.
ثم جاء أليكس فيسلهوفت ليبدأ في تغيير ذلك.
تخليق الحلقات
كان فيسلهوفت يعمل على إنجاز دراسته العليا بمعهد ماساتشوستس للتكنولوجيا (MIT)، في مدينة كامبريدج الأمريكية، حين شرع في تنفيذ منهجية «اللحام»، التي أسلفنا الإشارة إليها، ليتبيَّن له بعد ذلك أنها لم تكن فعَّالة في إنتاج حلقاتٍ أكبر. فالأمر أشبه بربط شريط طويل بطرفَي قوس: كلما زاد حجم الحمض النووي الريبي، أصبحت تحديات التعامل معه أشدَّ وضوحًا، مما يجعل من الصعب الوصول إلى بنية حلقية جيدة التكوين.
فما كان من فيسلهوفت إلا أن تحوَّل إلى الأخذ بنهج التضفير الذاتي (self-splicing)، فأقدم على تصميم شرائط حمض نووي ريبي تحتوي على لمناطق لتشفير البروتينات وعناصر IRES محاطة بتسلسلات التضفير الذاتي، وهو الطريق الذي سبقه إليه آخرون. ولكن بالتعاون مع الباحثَين المتخصصَين في الهندسة الحيوية، بيوتر كوالسكي، الذي يعمل الآن في جامعة كوليدج كورك في أيرلندا، ودان أندرسون، من معهد ماساتشوستس للتكنولوجيا، نجح فيسلهوفت في إضافة أجزاء تكميلية من الحمض النووي الريبي، وكذا تسلسلات لفواصل، في مناطق عدَّة على طول الجزيء، مما ساعد على تثبيت بنية «دبوس الشَّعر»، المُشار إليه آنفًا، التي تهيِّئ الجزيء للاستدارة، أو التدوير (circularization).
آتت هذه الجهود أُكُلها؛ إذ يمكن الآن للحمض النووي الريبي المخلَّق أن يلتفَّ حول نفسه بشكلٍ فعَّال، حتى في حالة التسلسلات الأطول7. وتبيَّن من التجارب التي أُجريت على الفئران أن هذه الجزيئات الحلقية يمكنها تحفيز إنتاج البروتينات لعدة أيام، في حين أن الجزيء الخطي من الحمض النووي الريبي المرسال (mRNA) أنتج البروتين لمدة لا تزيد على 24 ساعة8. ثم لم تلبث تقنية التدوير هذه، التي قُدِّمَتْ لأول مرة في دراسة منشورة عام 2018، أن أثبتت نفسها باعتبارها الطريقة الناجعة في هذا المضمار لتخليق الحمض النووي الريبي الحلقي في المختبر.
"أثمرت هذه التقنية عن تحسين واضح"، هذا ما قاله جيسون راوش، عالِم الكيمياء الحيوية المتخصص في دراسة الحمض النووي الريبي بالمعهد الوطني الأمريكي للسرطان، الكائن في مدينة فريدريك بولاية ميريلاند، وهو الذي اعتمد هذه التقنية في مشروع الحمض النووي الريبي الحلقي الخاص به.
في عام 2019، أسس فيسلهوفت وأندرسون، برفقة رافاييلا سكويلوني، رائدة الأعمال في مجال التكنولوجيا الحيوية، شركة لتسويق المنصة. الشركة الناشئة التي كانت تحمل في الأصل اسم «أوروبوروس بيو» Oroboros Bio، نسبةً إلى الثعبان الأسطوري الذي يشكل بجسمه حلقة ليلتهم ذيله، تغيَّر اسمها لاحقًا إلى «أورنا ثيرابيوتكس» Orna Therapeutics.
ومن موقعه بصفته رئيسًا لقسم البيولوجيا الجزيئية في الشركة، واصل فيسلهوفت تنقيح العملية وتحسينها. وفي النهاية، نجح في صناعة جزيء حمض نووي ريبي حلقي من الطول بحيث يقدر على تشفير الدستروفين (dystrophin)، وهو البروتين الضخم الذي يعاني من نقصه المصابون بمرض «دوشين» أو «الحثل العضلي الدوشيني» (Duchenne muscular dystrophy). كانت النسخة الواحدة تحتوي على 12 ألفًا من النيوكليوتيدات. ويقول فيسلهوفت إننا عندما نتحدث عن الدستروفين، فإنما "نتحدث عن المكوِّن الأكبر على الإطلاق في الجينوم البشري الذي يمكن لنا أن نرغب في التعبير عنه".
على أنَّ «أورنا» لم تكن الشركة الناشئة الوحيدة التي صقلَت قدرتها على تدوير الحمض النووي الريبي، فقد رافقَتْها في ذلك شركات أخرى، انتهجت أساليب مختلفة لبناء جزيئات الحمض النووي الريبي الدائرية.
بعض هذه الشركات تقوم بتحميل التعليمات الخاصة بتخليق الحمض النووي الريبي الدائري (circRNA) على نواقل فيروسية أو أشرطة الحمض النووي (DNA)، مُفسحةً بذلك المجال أمام إتمام عملية التضفير داخل الخلية. يقول أرافيند أسوكان، عالِم الفيروسات المخلَّقة بجامعة ديوك في مدينة دورهام بولاية نورث كارولينا، والمؤسس المشارك لشركة «تورك بيو» Torque Bio، الكائنة في ريسيرش تراينجل بارك بولاية نورث كارولينا: "الفيروس الذي قمنا بتخليقه ينوب عنَّا في أداء العمليات القذرة. وواقع الأمر أنه هو الذي ينهض بعملية إنتاج حلقة الحمض النووي الريبي داخل النواة."
أما شركة «تشيمرنا ثيرابيوتكس» Chimerna Therapeutics، ومقرُّها مدينة نيويورك، فتستعين بالبكتيريا المعدلة وراثيًا لتصنيع الحمض النووي الريبي الدائري بطريقة يقول الرئيس التنفيذي براين بيكرينج إنها "فعَّالة جدًا في توفير الوقت والمال"، مقارنةً بالجزيئات المولدة بالكامل في المختبر.
غير أن غالبية هذه الجهود تتكئ على بروتوكول فيسلهوفت. في أغسطس، أفاد فريق من شركة التكنولوجيا الحيوية «آرزينومكس» Rznomics في مدينة سونجنام الكورية الجنوبية، بابتكار نظام لتدوير الحمض النووي الريبي، يتلافى ترك أي تسلسلات تضفير ذاتي غير مرغوب فيها في حلقة الحمض النووي الريبي9. وعلى صعيدٍ متصل، أقدم باحثون من شركتين في الصين، هما «سركود بيوميديسن» CirCode Biomedicine في شنجهاي، وشركة «سوشو كيورميد بيوفارما» Suzhou CureMed Biopharma Technology، على نشر مسوَّدات بحثية – كلًّا على حدة – في العام الماضي، عرضوا فيها لأساليب مشابهة10،11.
يقول تشيجيان زو، رئيس قسم البحث والتطوير في شركة «سوشو كيورميد بيوفارما»: "الحمض النووي الريبي الحلقي النهائي لا يشتمل إلا على منطقة الترميز وموقع دخول الريبوسوم الداخلي (IRES)"، ولا يحتوي على أي تسلسلات أو مكونات غير مرغوب فيها.
نقاشٌ "دائر"
قد يكون من شأن إزالة هذه الأجزاء الإضافية من التسلسلات ضمان عدم إثارة حلقات الحمض النووي الريبي لاستجابات مناعية غير مرغوب فيها، وهي الاستجابات التي ربما تخصم من الفعالية العلاجية لهذه الحلقات. هذا أمر له أهميته، لاسيما إذا كنتَ تريد علاجًا يمكن إعطاؤه للفرد مرارًا وتكرارًا في مراحل عمره المختلفة، كما يقول توماس كيركيجور ينسن، الرئيس التنفيذي المشارك لشركة «ألوب ثيرابيوتكس» Aloop Therapeutics، التي تتخذ من العاصمة الدنماركية كوبنهاجن مقرًا لها، وتهدف إلى علاج الاضطرابات الجينية النادرة باستخدام حلقات الحمض النووي الريبي.
ويقول: "ما أحوجنا إلى التفكير في كل عنصر من شأنه أن يسهم في تكوين المناعة، ونحاول في الوقت نفسه تخفيف التأثيرات السلبية الواقعة عليها ما أمكن إلى ذلك من سبيل".
لكن الدراسات تختلف فيما بينها حول ما إذا كانت حلقات الحمض النووي الريبي تستحث إطلاق استجابات مناعية. تقول لِنج-لِينج تشِن، عالمة البيولوجيا المتخصصة في دراسة الحمض النووي الريبي بمعهد شنجهاي للكيمياء الحيوية وبيولوجيا الخلية: "الأمر يتوقَّف على طريقة صنع الدوائر". في بحث نُشر لأول مرة على الإنترنت في عام 2021، شرحت تشِن، رفقة زملائها، تفصيلًا كيف أن التسلسلات التي خلَّفتها عناصر التضفير الذاتي تؤدي إلى إحداث تشوُّهات في طي الحمض النووي الريبي، مما يؤدي إلى ظهور دوائر غير منتظمة البنية، تستثير رد فعل مناعي12.
ومع ذلك، ففي نفس الوقت تقريبًا، أفاد أوليفر روسباخ، عالم الكيمياء الحيوية المتخصص في دراسة الحمض النووي الريبي، ومعه زملاؤه في جامعة يوستوس ليبيش في مدينة جيسن الألمانية، أن السبب وراء ذلك ربما كان يكمُن في التلوث، وأنه يمكن الحد من التفاعلات أو التخلُّص منها تمامًا إذا ما اتُّبعت خطوات التنقية الصحيحة13. يقول روسباخ: "يجب أن تكون في غاية النظافة".
تجدُر الإشارة هنا إلى أنه، في بعض السياقات، ربما يكون التفاعل المناعي أمرًا مرغوبًا فيه. في حالة اللقاحات (سواء تلك التي تؤخَذ للوقاية من السرطان أو الأمراض المعدية)، نجد أن استثارة الجهاز المناعي يمكن أن يحفز إنتاج الأجسام المضادة والخلايا التائية. هذا ما اكتشفه ونشنج وي، الباحث المتخصص في تعديل الجينوم بجامعة بكين، وزملاؤه، عندما طوروا لقاحًا لفيروس كورونا (سارس-كوف-2) باستخدام حلقات الحمض النووي الريبي.
في تجارب أُجريَت على الفئران والقرود، تبيَّن أن لقاحًا قائمًا على الحمض النووي الريبي الدائري (circRNA) قد حفَّز إنتاج مزيد أجسامًا مضادة مدمرة للفيروسات تفوق تلك التي أنتجها اللقاح الخطي المصنوع من ذات النوع المعدَّل من الحمض النووي الريبي المرسال (mRNA) المستخدم في لقاحات «كوفيد-19» المعتمدة، وأدى إلى إطلاق استجابات أكثر فعالية، قوامها الخلايا التائية14. بل لوحظ أن للقاح الحمض النووي الريبي الدائري مَيزةً أخرى؛ وهي أنه كان أكثر استقرارًا من لقاح الحمض النووي الريبي المرسال في درجة حرارة الغرفة، مما قد يسمح بتخزين اللقاح ونقله دون متطلبات تبريد خاصة.
حاليًا، تعكف الشركة الناشئة التي أسسها وي، وهي شركة «ثيرورنا» Therorna، ومقرها بكين، على تجربة هذا اللقاح على البشر. ويُعتقد أن هذه التجربة هي الأولى التي تختبر دواء قائمًا على الحمض النووي الريبي الدائري المخلَّق على البشر. وفي العام المقبل، يمكن أن نشهد دخول بضعة عقاقير أخرى إلى مرحلة التجارب الإكلينيكية، بما في ذلك علاج السرطان الذي تطوِّره شركة «سوشو كيورميد» Suzhou CureMed، والذي يشفر جزيئًا محفزًا للمناعة، يسمى «إنترلوكين-12».
وفي الأثناء، تُشمِّر شركة «أورنا» عن ساعديها لبدء تجارب عقار يقوم على الحمض النووي الريبي الحلقي في عام 2024، بُغية إعادة برمجة الخلايا المناعية بحيث تهاجم خلايا سرطان الدم. في مؤتمر عُقد في شهر مايو، أظهر علماء يعملون لدى «أورنا» أن العقار المرشح لأداء هذه المهمة، حتى عند تناوله بجرعات منخفضة، يمكنه القضاء على الأورام في نموذج فأري لسرطان الدم الذي يصيب البشر، دون إجراء أية تعديلات معقدة على الخلايا، ودون حاجة كذلك إلى أنظمة دوائية تحضيرية مكثفة، تتطلبها معظم العلاجات المناعية الشبيهة المتاحة اليوم.
حديث الأولويات
يمكن لحلقات الحمض النووي الريبي أن المخلَّقة أن تذهب إلى ما هو أبعد من مجرد تشفير البروتينات العلاجية. عند طيّ هذه الجزيئات في أشكال معينة، يمكنها أن تعمل عمل الأجسام المضادة، وترتبط مباشرة بالعناصر المستهدفة، مما يؤدي إلى نشوء نوع من الأدوية يعرف بالأبتمرات (aptamers). في إمكانها أيضًا التقاط أنواع مختلفة من الجزيئات التنظيمية، وعزلها، وفصلها بشكل فعال عن البيئة المحيطة بها في الخلية.
بل ويمكنها أن تعمل بمثابة عوامل عاكسة لاتجاه النَّسخ: ترتبط بنُسخ الجينات، وتعوق عملية التعبير عنها، أو تغيِّر مسارها. علاوة على ذلك، يمكن لهذه الجزيئات أن تعمل بمثابة جزيئات إرشادية لتطبيقات تعديل الحمض النووي الريبي، وتوجيه الإنزيمات المتخصصة نحو نُسخ جينات المرض المتطفِّرة، التي تحتاج إلى تصحيح. كل هذه التطبيقات تخضع للفحص والاستكشاف من قبل العديد من الشركات الناشئة.
غير أن الجزء الأكبر من الاستثمارات التي تُضخُّ في هذا المضمار تصبُّ في مسار التعبير عن البروتينات. وقد تركَّز جانبٌ كبير من جهود البحث والتطوير المبكرة على إيجاد طرق لتحسين كفاءة إنتاج منصة الحمض النووي الريبي الحلقي. يقول زيفينج وانج، عالِم البيولوجيا المتخصص في دراسة الحمض النووي الريبي بمعهد بارتنر للبيولوجيا الحاسوبية في شنجهاي، والمؤسس المشارك لشركة «سركود بيوميديسن»: "إذا أنت أدخلتَ ما يكفي من التحسينات، فسوف تحصل على نتيجة أفضل".
بالنسبة لمعظم فرق البحث، تبدأ هذه العملية بموقع دخول الريبوسوم الداخلي (IRES). في النتائج التي نُشرت لأول مرة في العام الماضي، على سبيل المثال، نجح تشانج وزملاؤه في تمييز العشرات من عناصر موقع دخول الريبوسوم الداخلي لعدة فيروسات بشكل منهجي، واكتشفوا العديد منها؛ ما مكَّن من التعبير عن البروتينات بشكل أقوى من تلك التي يشيع استخدامها في الأوساط العلمية. وعن طريق التعديل في بعض عناصر التصميم الأخرى، نجحوا أيضًا في تعظيم إنتاجية حلقات الحمض النووي الريبي عدة مئات من المرات، واستطاعوا بذلك الحفاظ على إنتاج البروتين على مدار أيامٍ عدَّة15.
يقول تشانج: "التحسينات تتمُّ على نحوٍ منتظم ومتكرر، بحيث يجوز لنا أن نقول إنها مكدَّسة، بعضها فوق بعض".
لكن التقدم جاء على فترات متقطعة، ومع نضوج هذا المجال، واجه صعوبات متزايدة.
في شهر يونيو الماضي، ترامَتْ أنباء عن قضايا تخص سلامة البيانات في شركة «لاروند» Laronde، وهي واحدة من الشركات الناشئة التي تتلقى تمويلًا باذخًا في هذا المجال. وعلى أثر ذلك، اضطُرت الشركة، ومقرها مدينة سومرفيل بولاية ماساتشوستس الأمريكية، إلى التخلي عن أحد برامجها الدوائية الأكثر تقدمًا.
إلا أن هذه الانتكاسات، على حد وصف الرئيس التنفيذي للشركة، جون ميندلين، "لا تعكس موقف الشركة اليوم، كما لا تُنبئ عن طبيعة هذا الحقل العلمي، ولا الأشخاص المنتسبين إليه". ومع ذلك، فقد ألقى الحادث بظلال من الشك بين بعض المراقبين حول مستقبل حلقات الحمض النووي الريبي.
على أن الدوائر والخطوط ليست هي الطرق الوحيدة لتشفير العلاجات المعتمدة على الحمض النووي الريبي. يرى عديد من الباحثين أن المجال بحاجة إلى تقنيات تدوم فعاليتها لفترة أطول، مثل الأحماض النووية الريبية ذاتية التضخيم، والتي يمكنها التناسُخ داخل الخلية، من أجل تحويل الحمض النووي الريبي المخلَّق إلى علاج فعال للعديد من الحالات المزمنة.
لكن فيسلهوفت، الذي يشغل حاليًا منصب مدير علاجات الحمض النووي الريبي في معهد ماس جنرال بريجهام للعلاج الجيني والخلوي في مدينة كامبريدج الأمريكية، لا يزال مستمسكًا بتفاؤله بشأن الجزيئات الدائرية. وحتى مع كل النجاح الذي حققته اللقاحات القائمة على النُّسَخ الخطية من الحمض النووي الريبي المرسال (mRNA)، يظلُّ على رأي بأن الحمض النووي الريبي الدائري (circRNA) هو المستقبل. يقول: "ستكون التقنية المفضَّلة من بين تقنيات العلاج بالحمض النووي الريبي".
doi:10.1038/nmiddleeast.2023.254
References
1. Sänger, H. L., Klotz, G. Riesner, D., Gross, H. J. & Kleinschmidt, A. K. Proc. Natl Acad. Sci. USA 73, 3852–3856 (1976).
2. Nigro, J. M. et al. Cell 64, 607–613 (1991).
3. Moore, M. J. & Sharp, P. A. Science 256, 992–997 (1992).
4. Puttaraju, M. & Been, M. Nucleic Acids Res. 20, 5357–5364 (1992).
5. Ford, E. & Ares, M. Jr Proc. Natl Acad. Sci. USA 91, 3117–3121 (1994).
6. Chen, C.-Y. & Sarnow, P. Science 268, 415–417 (1995).
7. Wesselhoeft, R. A., Kowalski, P. S. & Anderson, D. G. Nature Commun. 9, 2629 (2018).
8. Wesselhoeft, R. A. et al. Mol. Cell 74, 508–520 (2019).
9. Lee, K. H. et al. Mol. Ther. Nucleic Acids 33, 587–598 (2023).
10. Chen, C. et al. Preprint at bioRxiv https://doi.org/10.1101/2022.05.31.494115 (2022).
11. Qui, Z. et al. Preprint at bioRxiv https://doi.org/10.1101/2022.06.20.496777 (2022).
12. Liu, C.-X. et al. Mol. Cell 82, 420–434 (2022).
13. Breuer, J. et al. Mol. Ther. Nucleic Acids 28, 623–635 (2022).
14. Qu, L. et al. Cell 185, 1728–1744 (2022).
15. Chen, R. et al. Nature Biotechnol. 41, 262–272 (2023).
تواصل معنا: