新型コロナウイルスが細胞に侵入する仕組み
コンピューターでシミュレーションした新型コロナウイルス(SARS-CoV-2)の構造。 Credit: JANET IWASA, UNIV. UTAH
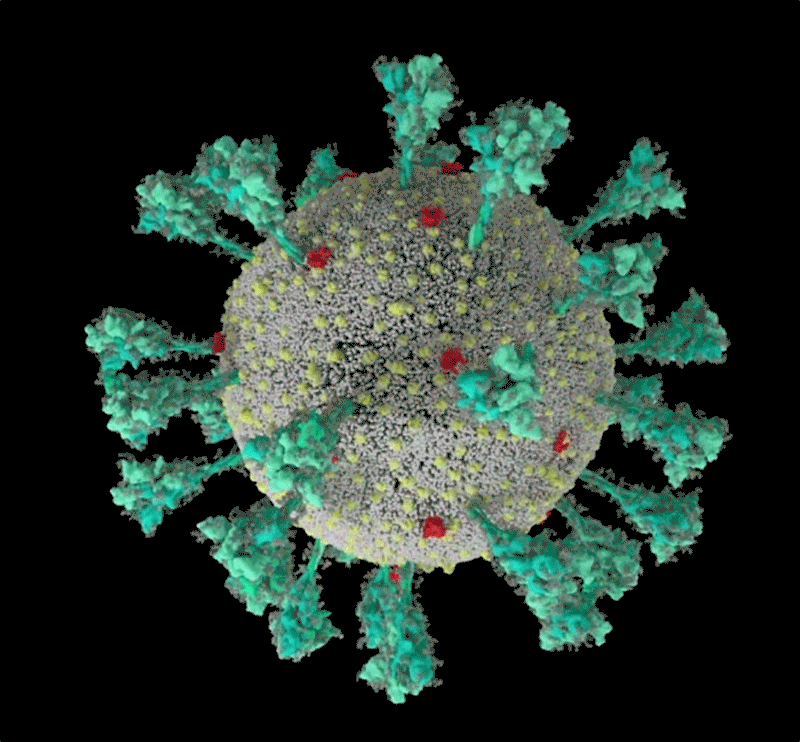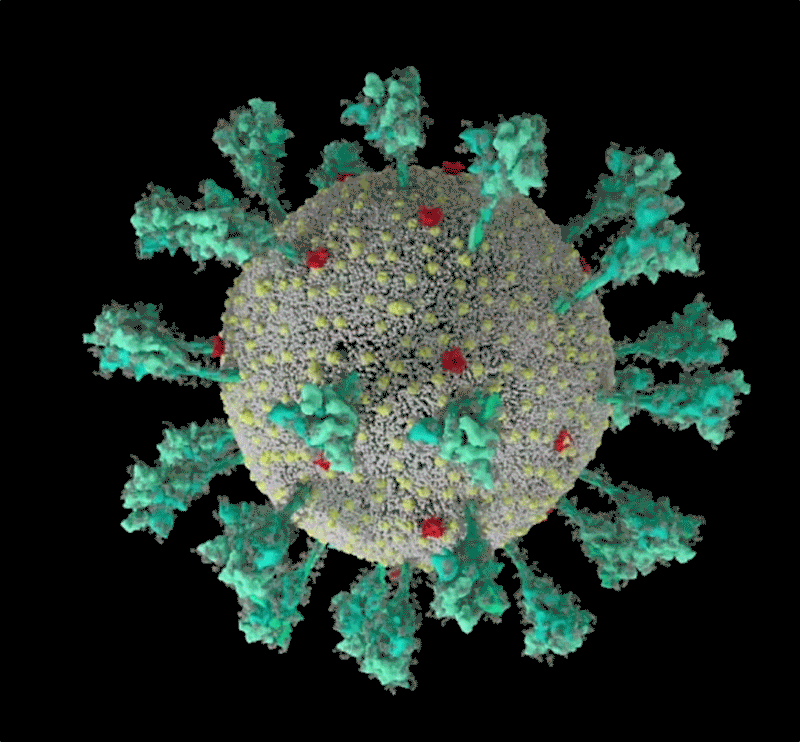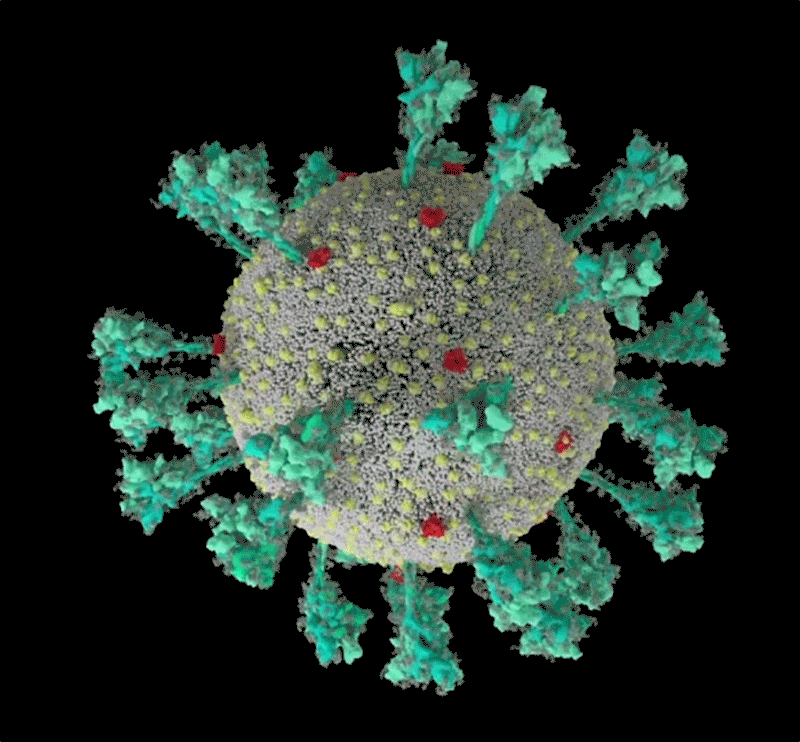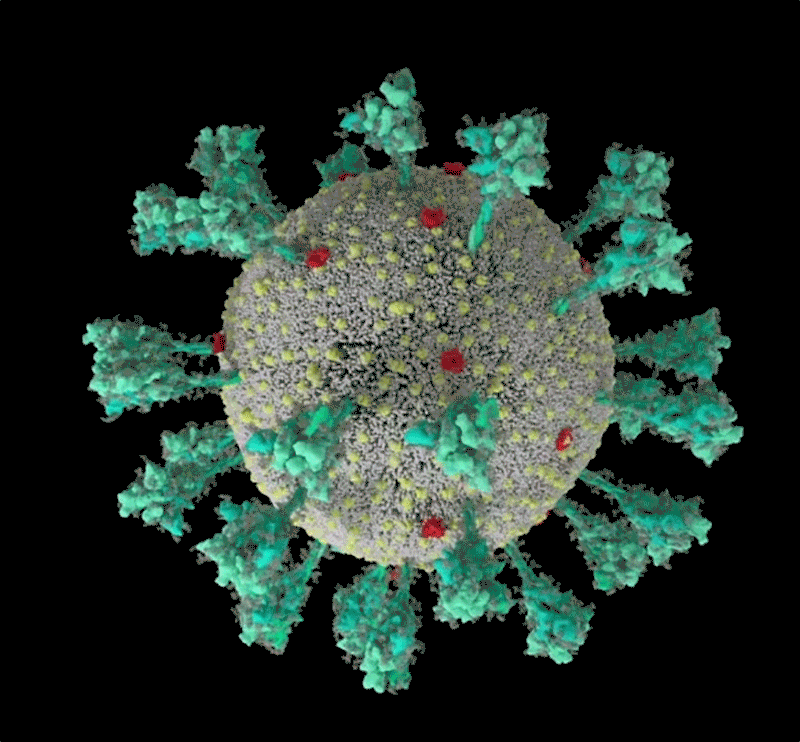
Janet Iwasa, University of Utah
このコロナウイルスは、豪奢な糖の衣をまとっている。重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)のトレードマークであるスパイクタンパク質の1つをコンピューター・シミュレーションで見たRommie Amaroは、目を見張った。ウイルスの表面から突き出すスパイクタンパク質には、糖鎖がびっしりと巻き付いていたのである。
カリフォルニア大学サンディエゴ校(米国)の計算生物物理化学者であるAmaroは、「これだけの糖鎖で覆われていたら、ほとんど認識できません」と言う。
実際、外側のタンパク質を糖鎖で覆い、羊の皮をかぶった狼のように私たちの免疫系の監視の目を欺いているウイルスは多い。しかし2020年、Amaroの研究チームと共同研究者らは、SARS-CoV-2の構造データと遺伝子データに基づき、スーパーコンピューターを使って糖鎖の原子を1個ずつレンダリングして、糖の衣を過去最高の詳細さで視覚化した。2020年3月22日、彼女がそのシミュレーションの結果をTwitterに投稿すると、1時間もしないうちにある研究者が、「タンパク質のてっぺんから突き出ている、糖鎖に覆われていない裸のループは何ですか?」とコメントしてきた。
Amaroには見当もつかなかったが、その10分後、テキサス大学オースティン校(米国)の構造生物学者Jason McLellanが、糖鎖に覆われていないループは「受容体結合ドメイン(receptor binding domain;RBD)」だと教えてくれた。RBDは、ウイルスのスパイクタンパク質がヒト細胞上の受容体に結合する際に用いる3つのセクションのうちの1つである(「糖鎖に覆われたスパイクタンパク質」参照)。
糖鎖に覆われたスパイクタンパク質
SARS-CoV-2のスパイクタンパク質は、鎖状につながった糖分子(糖鎖)で覆われることで免疫系の監視を逃れている。スパイクタンパク質のストーク(柄)には3つの関節(腰部、膝部、足首部)があり、スパイクタンパク質に柔軟性を付与している。 Credit: SOURCE: STRUCTURAL IMAGE FROM LORENZO CASALINO, UNIV.CALIFORNIA, SAN DIEGO (REF. 1); GRAPHIC: NIK SPENCER/NATURE
Amaroはシミュレーションで、RBDを持ち上げて糖鎖の雲の上に出してみた。すると、2本の糖鎖がさっと近づいてきて、自転車のキックスタンドのようにRBDをあるべき位置に固定した。また、コンピューターモデル上でこれらの糖鎖を変異させると、RBDは崩壊した。McLellanのチームは同じ実験を実際に行う方法を編み出し、両チームは2020年6月には、この2本の糖鎖を変異させるとスパイクタンパク質がヒト細胞の受容体に結合する能力が低下することを報告した1。McLellanによると、コロナウイルスの糖鎖にこのような役割があることはそれまで知られていなかったという。Amaroは、この2本の糖鎖を切り取ることでウイルスの感染力を弱められるかもしれないが、切り取る方法はまだないと語る。
新型コロナウイルス感染症(COVID-19;SARS-CoV-2により引き起こされる感染症)のパンデミックが始まって以来、科学者たちはSARS-CoV-2が細胞に感染する仕組みを詳細に解明してきた。彼らは感染プロセスを解き明かすことで、治療法やワクチンを改良したり、デルタ株をはじめとする新しい変異株の感染力が強まっている理由を解明したりしたいと考えている。
SARS-CoV-2の研究はパンデミックとともに始まったが、過去数十年間のコロナウイルス研究に裏打ちされ、ヒト細胞に侵入する過程の詳細が次々と解明されている(「新型コロナウイルス(SARS-CoV-2)のライフサイクル」参照)。科学者たちは、このウイルスが持つ能力、つまり、驚くべき強さでヒト細胞に結合できることや、細胞内でうまく身を隠すことに関わる、重要な適応を発見した。より最近では、新しいウイルス粒子が細胞の外に出ていく際にも、ある重要なプロセシング段階を経ることで、より多くのヒト細胞に感染するための準備を整えていることが分かった。これらは、急速な伝播を可能にする能力と、多くの人命を奪う能力をこのウイルスにもたらした道具の一部にすぎない。ロンドン大学インペリアルカレッジ(英国)のウイルス学者Wendy Barclayは、「このウイルスを制御下に置くのが難しい理由はそこにあります」と言う。
新型コロナウイルス(SARS-CoV-2)のライフサイクル
SARS-CoV-2 が細胞内に侵入してから放出されるまでの流れを簡略化して説明する。 Credit: SOURCE: HUI (ANN) LIU, UNIV. UTAH (HTTPS://ANIMATIONLAB.UTAH.EDU/COVA); GRAPHIC: NIK SPENCER/NATURE
鎧をまとう
まず、スパイクタンパク質の説明から始めよう。SARS-CoV-2のウイルス粒子の外側にはエンベロープと呼ばれる脂質膜があり、その表面には24~40個のスパイクタンパク質が無造作に並んでいる。これが、ウイルスがヒト細胞と融合する際のカギとなっている2。インフルエンザウイルスなどの場合、エンベロープから突き出ている膜融合タンパク質は比較的硬い。しかしマックス・プランク生物物理学研究所(ドイツ・フランクフルト)の生化学者Martin Beckらが2020年8月に発表した論文によると、SARS-CoV-2のスパイクタンパク質は極めて柔軟で、3つの「関節」があるという3。
このような構造を持つスパイクタンパク質は、パタパタと動いたり、ぐらついたり、回転したりすることができるので、細胞の表面を探ったり、複数のスパイクタンパク質を1つのヒト細胞に結合させたりするのが容易になると考えられる。他のコロナウイルスに関する同様の実験データはないものの、スパイクタンパク質の配列は進化的に高度に保存されているため、この特性は共有されていると考えるのが妥当だろうとBeckは言う。
パンデミックの初期に、SARS-CoV-2のスパイクタンパク質のRBDがヒトのACE2受容体に結合することが確認された。ACE2受容体は、咽喉や肺のほとんどの細胞の表面にある、よく知られているタンパク質だ。重症急性呼吸器症候群(SARS)の原因ウイルスであるSARS-CoVもACE2受容体に結合するが、SARS-CoV-2の結合力はこれよりも2~4倍も強いと推定されている4。RBDに複数の変化が起きて、ウイルスの結合ホットスポットが安定化しているからである5。
SARS-CoV-2の変異株の中でも特に懸念されているものには、スパイクタンパク質のS1サブユニットに変異があることが多い。S1サブユニットにはRBDがあり、ACE2受容体との結合を担っている(S2サブユニットはウイルスと宿主細胞膜との融合を担っている)。
例えばアルファ株では、スパイクタンパク質の配列が10カ所変化した結果、RBDは「アップ型」という配置にとどまりやすくなっている6。デューク大学ヒトワクチン研究所(米国ノースカロライナ州ダラム)の構造生物学者で、スパイクタンパク質の変異を研究しているPriyamvada Acharyaは、「ウイルスが細胞内に侵入しやすくなる配置です」と説明する(2020年12月号「コロナウイルスの変異を理解する」参照)。
現在世界中に広がっているデルタ株は、S1サブユニットに複数の変異がある。そのうちの3つはRBDにあり、RBDがACE2と結合して免疫系の監視から逃れる能力を高めているようだ7。
狭き門をくぐる
ウイルスのスパイクタンパク質がACE2に結合すると、宿主細胞の表面にある他のタンパク質が、ウイルスの膜を宿主の細胞膜と融合させるためのプロセスを開始する。
SARS-CoVは、宿主の2種類のプロテアーゼ(タンパク質分解酵素)のいずれかを利用して細胞内に侵入する。1つはTMPRSS2(「テンプレス・ツー」と読む)という酵素で、もう1つはカテプシンLという酵素である。TMPRSS2を利用する方が速やかに侵入できるが、SARS-CoVは多くの場合、カテプシンLを利用してエンドソーム(脂質に囲まれた小胞)経由で細胞内に侵入する。しかし、この経路で細胞内に侵入したウイルス粒子は、抗ウイルスタンパク質に捕まってしまう。
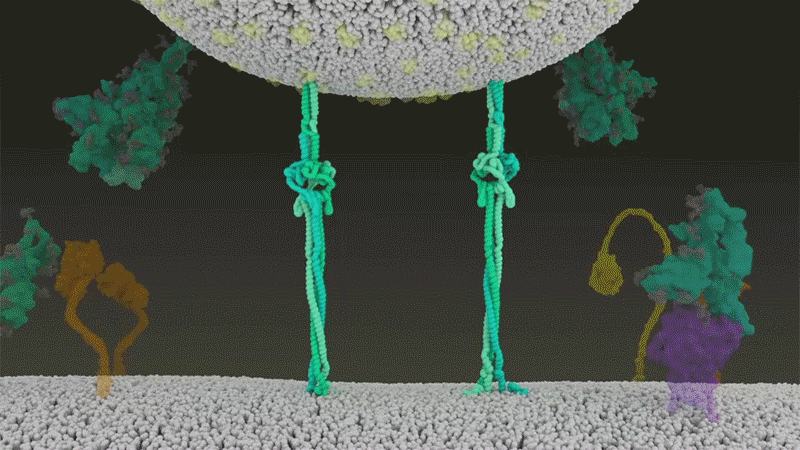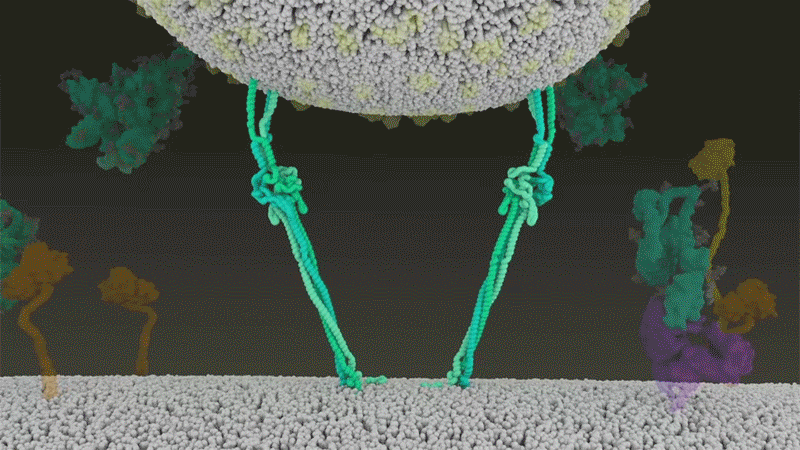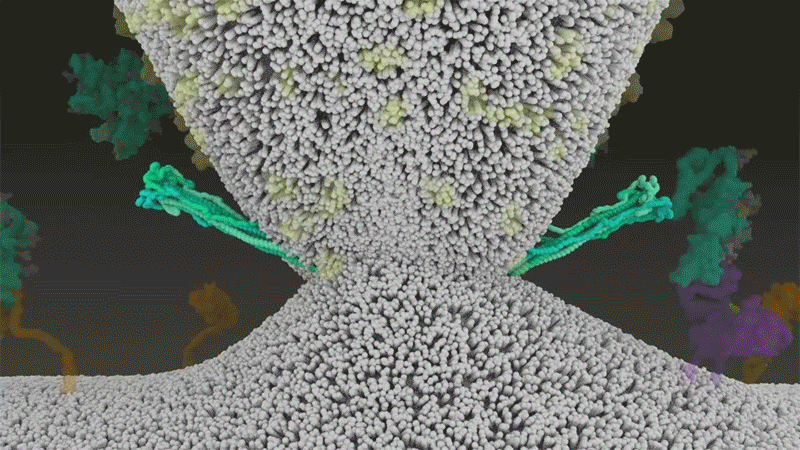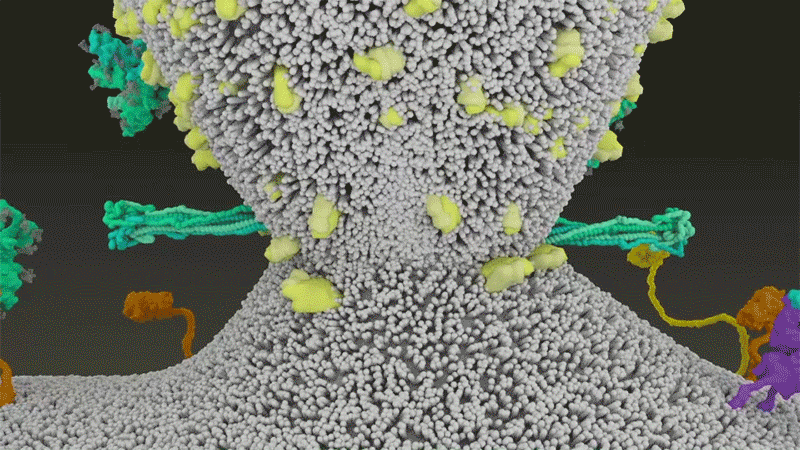
SARS-CoV-2は、呼吸器細胞の外側に大量にあるTMPRSS2を効率よく利用する点でSARS-CoVと異なっている。TMPRSS2はまず、スパイクタンパク質のS2サブユニットの特定の部位を切断する8。これにより、スパイクタンパク質の疎水性アミノ酸の並びが露出する。これらのアミノ酸は、一番近くにある膜(宿主細胞膜)の中に速やかに潜り込む。次に、長く伸びていたスパイクタンパク質が折り畳まれることで、ジッパーを閉じるようにウイルスと細胞膜が融合する(「宿主細胞に侵入するウイルス」参照)。
宿主細胞に侵入するウイルス
タンパク質分解酵素TMPRSS2がSARS-CoV-2のスパイクタンパク質を切断すると、スパイクタンパク質中の疎水性アミノ酸の並びが露出する。これらが一番近くにある膜(宿主細胞膜)に速やかに埋め込まれることで、ウイルスと宿主細胞膜が融合する。 Credit: SOURCE: JANET IWASA, UNIV. UTAH (HTTPS://ANIMATIONLAB.UTAH.EDU/COVA); GRAPHIC: NIK SPENCER/NATURE
Janet Iwasa, University of Utah
細胞膜と融合したウイルスは、細胞内に直接ゲノムを放出する。Barclayとロンドン大学インペリアルカレッジの同僚が2021年4月に発表した論文によると、SARS-CoV-2はばねで固定するようにして細胞内に侵入することで、SARS-CoVよりも速く感染し、エンドソームに取り込まれるのを避けているという9。
抗マラリア薬のクロロキンは、実験室での初期の研究10ではCOVID-19治療薬として有望そうに見えたが、臨床試験ではうまくいかなかった。その理由は、SARS-CoV-2がTMPRSS2を利用して速やかに細胞内に侵入することで説明がつく。初期の研究で使っていた細胞には、カテプシンLを利用してエンドソーム経由で侵入する経路しかなかったのだ。Barclayは、「SARS-CoV-2がヒトの気道に感染して増殖する際にはエンドソームは利用しないため、エンドソームを破壊するクロロキンでは効果がなかったのです」と説明する。
この発見は、ウイルスがTMPRSS2やカテプシンLなどのプロテアーゼを使って宿主細胞内に侵入するのを防ぐ治療薬として、プロテアーゼ阻害剤が有望であることも示している。TMPRSS2阻害剤の1つで、日本で膵炎の治療薬として承認されているカモスタットメシル酸塩は、ウイルスが肺細胞に侵入するのを阻止できることが報告された8。ただし、初期の臨床試験では患者の転帰を改善することはできなかった11。
ドイツ霊長類センター(ゲッティンゲン)の感染生物学ユニットのディレクターで、ACE2の結合とTMPRSS2経路を調べる研究チームを率いるStefan Pöhlmannは、「個人的には、このようなプロテアーゼ阻害剤を、新たな感染症のアウトブレイクと戦い、将来のパンデミックを未然に防ぐための広域抗ウイルス剤として利用するべきだと考えています」と語る。
激しい競争
ここから先の話は不透明になってくる。ウイルスのライフサイクルに関する注釈付きのアニメーションを制作しているユタ大学(米国ソルトレークシティー)の化学者Janet Iwasaは、「細胞内に入ると、ブラックボックスが一気に増えます。不確実性が増し、仮説が錯綜しています」と言う。
ウイルスが自分のRNAゲノムを細胞内に放出すると、細胞質中のリボソームがウイルスRNAの2つのセクションを翻訳して長いアミノ酸配列を作る。この長いアミノ酸は切断されて16種類のタンパク質となり、これにはRNA合成に関わるタンパク質が多数含まれているので、さらに多くのウイルスRNAが作られる。これらのRNAには、新しいウイルス粒子を作るのに必要なスパイクタンパク質をはじめとする構造タンパク質やその他のアクセサリータンパク質など、合計26種類の既知のウイルスタンパク質がコードされている。ウイルスはこうして自分自身のメッセンジャーRNA(mRNA)のコピーを作り始めるのだが、mRNAを翻訳してウイルスタンパク質を作るには、宿主の細胞機構が必要だ。
コロナウイルスは、さまざまな方法で宿主の細胞機構を乗っ取っている。ワイツマン科学研究所(イスラエル・レホボト)のウイルス学者Noam Stern-Ginossarが率いる研究チームは、SARS-CoV-2が自身のmRNAの翻訳を優先させるために宿主のmRNAの翻訳を抑制する3つの機構に注目した。彼女は、「どれもこのウイルスに限った機構ではありませんが、その組み合わせ、速さ、効果の大きさは他に類を見ません」と語る。
第1の機構では、ウイルスは競争相手を排除する。細胞内で最初に翻訳されるウイルスタンパク質の1つであるNsp1は、宿主のタンパク質を動員して、ウイルスのタグが付いていない宿主細胞の全てのmRNAを体系的に切り刻む。Stern-Ginossarの研究チームが宿主のmRNAの末端に同じタグを付けたところ、そのmRNAは切り刻まれなかった12。
第2の機構では、ウイルスは感染細胞内のタンパク質の翻訳を全体で70%減少させる。2つの研究チームの研究によると、ここでもNsp1が主要な役割を果たしていて、リボソームのmRNAチャネルを物理的に塞いで、mRNAが中に入れないようにしているという13,14。Stern-Ginossarは、わずかに残った翻訳能力はウイルスRNAの翻訳に利用されるとしている。
第3の機構では、ウイルスは細胞の警報システムを停止させる。これにはさまざまな方法があるが、Stern-Ginossarの研究チームは、SARS-CoV-2が確実に採用している機構を1つ特定した。それは、宿主細胞のmRNAが核外に出るのを阻止するという方法である。阻止されるmRNAには、免疫系への感染警報となるタンパク質に向けた指示も含まれている。別のチームがこの発見を裏付けた。ここで阻止を担っているのもNsp1だった。Nsp1は核膜孔を塞いで、何物も核外に出られないようにしているようである15。
遺伝子転写物が核外に出られないため、ウイルスに感染した細胞が放出するインターフェロン(免疫系にウイルスの存在を知らせるシグナル伝達タンパク質)の量は少ない。SARS-CoV-2は警報システムを停止させる能力が特に高く、このウイルスの感染によるインターフェロンの放出量は、他の呼吸器ウイルス(SARS-CoVやRSウイルスなど)に比べて著しく少ない16。2021年6月には、アルファ株にインターフェロンの産生をさらに効率よく抑制できると思われる変異があることが報告された17。
Stern-Ginossarは、「SARS-CoV-2が非常に速く感染するウイルスであり、感染の初期段階での免疫系による認識・対処を阻止する特異な能力を備えていることは明らかです」と言う。免疫系がウイルスの存在に気付くころにはウイルスの量が多過ぎて、通常よりも大量の免疫反応タンパク質が血流中に一気に放出され、かえって体を傷つけてしまうことがある。医師たちはパンデミックの初期に、重症化したCOVID-19患者の中には、ウイルスによる損傷だけでなく、ウイルスに対する過剰な免疫反応による損傷も受けている人がいることに気付いていた。有効性が証明されている治療法の中には、この免疫反応を抑制するものもある(2020年8月号「ステロイド薬がCOVID-19による死亡を防ぐ」参照)。
細胞の改造
SARS-CoV-2のスパイクタンパク質(緑)を発現する細胞に見られる融合細胞構造(シンシチウム)。核は青、細胞骨格は赤で示す。 Credit: MAURO GIACCA
宿主細胞の翻訳機構を乗っ取ったウイルスは、細胞の改造に取り掛かる。ウイルスの必要に合わせて、細胞の内部と外部を大きく作り変えるのだ。
最初に、新たに作られたウイルスのスパイクタンパク質のいくつかが細胞の表面に移動し、宿主の細胞膜から外に突き出す。そこで宿主細胞のカルシウムイオンチャネルを活性化して、細胞の外側に脂質でできた被膜を排出させる。この被膜は、自然に融合するタイプの細胞(筋細胞など)に見られる被膜と同じものだ。やがて感染細胞はACE2を発現している近隣の細胞と融合し、最大20個ほどの核を持つ1つの巨大な呼吸器細胞へと成長する。
このような融合細胞はシンシチウムと呼ばれる。SARS-CoV-2の感染によりシンシチウムが形成されることを発見した研究チームを率いた、ロンドン大学キングスカレッジ(英国)の分子生物学者Mauro Giaccaは、この結果を2021年4月に発表した18。シンシチウムはHIVや単純ヘルペスウイルスなどに感染すると形成されるが、SARS-CoVでは形成されないと彼は言う。また、シンシチウムを形成することで、感染細胞は長期にわたって生き残り、より多くのウイルス粒子を作れるようになるのではないかと考えている。「SARS-CoV-2の攻撃は一時的なものではなく、持続するのです」とGiacca。中国医学科学院(北京)の研究者Qiang Sunが率いる別のチームは、SARS-CoV-2に感染した細胞の中には、体内の免疫細胞の1つであるリンパ球とシンシチウムを形成するものさえあることを発見した19。これは腫瘍の免疫逃避機構として以前から知られているが、ウイルスでは知られていなかった。この発見は、SARS-CoV-2に感染した細胞が、近くにいる免疫系の偵察隊にしがみ付いて合体することで免疫系の監視の目をかいくぐっていることを示唆している。
細胞の内部では、さらに多くの変化が起こっている。細胞内には、扁平な膜からなり、タンパク質の合成と輸送に関わる小胞体(ER)という網状構造があるのだが、他のコロナウイルスと同様にSARS-CoV-2も、長くて薄い小胞体をシャボン玉のように膨らませて、球状の二重膜小胞(double-membrane vesicle;DMV)に変えてしまう。DMVは、ウイルスRNAが細胞内の自然免疫系に探知されることなく複製・翻訳される「隠れ家」のような役割を果たしている可能性があるが、この仮説はまだ検証中である。
DMVの形成に関与するタンパク質は、ウイルスの複製に必要と見られるので、良い創薬ターゲットになりそうだ。例えば、コレステロールやその他の脂質を動員して小胞体膜を拡張し、ウイルスの全てのパーツが膜の中に収まるようにするためには、宿主のTMEM41Bというタンパク質が必要だ20。この研究に携わったテキサス大学医学部ガルベストン校(米国)のコロナウイルス研究者であるVineet Menacheryは、「TMEM41Bを除去すると、感染に大きな影響が出ます」と言う。コロナウイルスの膜貫通タンパク質Nsp3も、良い標的になるかもしれない21。Nsp3は、DMVの壁に王冠型の孔を作り、新たに作られたウイルスRNAを送り出している。
外被にエンベロープを持つウイルスのほとんどは、細胞の端に近いところで細胞膜の一部を利用しながらエンベロープを組み立てて、外に出ていく。しかしコロナウイルスの場合、新たに作られたタンパク質は、これとは異なる経路を取る。
何年も前から、コロナウイルスはゴルジ複合体を経由して細胞外に輸送されることが示唆されていた。ゴルジ複合体は郵便局のような働きをする細胞小器官で、分子を膜で包み込み、細胞内の他の場所に送り出している。30年にわたってコロナウイルスを研究してきたジョンズホプキンス大学(米国メリーランド州ボルティモア)のウイルス学者で細胞生物学者のCarolyn Machamerは、コロナウイルスはゴルジ複合体の膜から脂質エンベロープを形成すると説明する。新たに形成されたウイルス粒子は、ゴルジ小胞の中に入って細胞表面まで運ばれ、細胞外に吐き出される。
しかし2020年12月、国立心肺血液研究所(米国メリーランド州ベセスダ)の細胞生物学者Nihal Altan-Bonnetらが、コロナウイルスがリソソーム(細胞の部品を分解するための酵素が詰まったごみ箱のような細胞小器官)を通って細胞から出ていくのを検出したと報告した22。だから、ゴルジ複合体を利用する分泌経路を遮断しても、感染力のあるウイルスの放出量には影響がないようだと、Altan-Bonnetは言う。彼女のチームがつかんだ証拠22によると、ウイルスタンパク質は小胞体の中に出芽してエンベロープを形成した後、リソソームを乗っ取って細胞外に出るようである。研究チームは現在、抗ウイルス薬の候補として、リソソームからの脱出過程を阻害する薬剤の試験を行っている。
ゴルジ複合体やリソソームを経由して細胞の外に出るのは、細胞膜から出芽するのに比べて時間がかかり、効率も悪いため、SARS-CoV-2がなぜこのような方法を取るのかは分かっていない。Machamerは、ゴルジ複合体やリソソームに由来するエンベロープは、細胞膜に由来するエンベロープに比べて、脂質組成の点でウイルスにとってメリットが大きいのではないかと考えている。彼女は、「この部分をもう少し解明できれば、新しい抗ウイルス治療法につながるかもしれません」と期待している。
最後の仕上げ
ウイルスが細胞の外に出る際に起こる1つのイベントが、新しいウイルスを「感染力のある怪物」にする。ウイルス中の5個のアミノ酸からなる配列が切断されることで、外に出るときには次の標的に侵入する準備が整っているのだ。
他のコロナウイルスでは、スパイクタンパク質のS1サブユニットとS2サブユニットの接合部にはアルギニンというアミノ酸が1個あるだけなのに対し、SARS-CoV-2では、プロリン(P)、アルギニン(R)、アルギニン(R)、アラニン(A)、アルギニン(R)という順序で5個のアミノ酸が並んでいる。「珍しいと思ってこの部位に着目したところ、やはり肺細胞への侵入に必須の部位であることが分かりました」とPöhlmannは言う。2020年5月、彼とその同僚は、宿主細胞の「フリン(furin)」というプロテアーゼがこのPRRAR配列を認識して切断すること、そしてこの切断が、ウイルスがヒトの肺細胞に効率よく侵入するために「必須」であることを報告した23。
ウイルス上にフリン切断部位が見つかったのはこれが初めてではない。高病原性鳥インフルエンザウイルスにもこの部位があるとBarclayは言う。フリン切断部位を自然に失ったSARS-CoV-2培養株を同僚から受け取ったBarclayのチームは、この株に感染したフェレットが排出するウイルス粒子の量はパンデミック株に感染したフェレットのウイルス排出量よりも少なく、近くにいる動物に感染が広がらなかったことを明らかにした9。彼女のチームが2020年9月にプレプリント論文でこの結果を報告したのと同じ時期に、オランダで行われた研究からも、フリン切断部位を改変していないコロナウイルスは、この部位を改変したものよりも速くヒトの気道細胞に侵入することが明らかになっている24。
フリンは、ウイルス粒子が組み立てられる時か、放出される直前に、切断部位を切ると考えられている。ロヨラ大学シカゴ校(米国イリノイ州)のウイルス学者Tom Gallagherは、ウイルスがゴルジ複合体またはリソソームを経由して細胞の外に出ていく理由は、このタイミングによって説明できるかもしれないと言う。「組み立てられたウイルスは、フリンがたっぷりある細胞小器官の中に移動するわけです」。
フリンは、スパイクタンパク質のS1サブユニットとS2サブユニットの間の結合を切断することで、このタンパク質を緩めている。この状態のウイルスが次の細胞内に侵入する際に、TMPRSS2による2回目の切断を受けて疎水性領域が露出し、この領域が速やかに宿主細胞膜に埋もれるとGallagherは言う。スパイクタンパク質が事前にフリンによる切断を受けていない場合は(実際、常に切断されているわけではない)、TMPRSS2による切断も受けず、細胞内に侵入するときにはエンドソーム経路からゆっくり侵入することになる。
新型コロナウイルスの変異株のうちアルファ株とデルタ株は、フリン切断部位が変化している。アルファ株では、最初のプロリン(P)がヒスチジン(H)に変わっていて(P681H変異)、デルタ株ではこれがアルギニン(R)に変わっている(P681R変異)。どちらの変化もアミノ酸配列の酸性度を下げている。アミノ酸配列の塩基性度が上がるほど、フリンは効率よくこれを認識・切断することができるとBarclayは言う。「ウイルスの感染力は、これによりさらに高まったのではないかと考えています」(2ページ「デルタ株の爆発的な広がりを可能にした変異」参照)。
フリンに切断されやすくなるということは、ヒト細胞に侵入する準備ができたスパイクタンパク質が増えるということだ。Menacheryの研究グループは、侵入準備が整ったスパイクタンパク質を定量した。彼らの未発表データによると、SARS-CoVではヒト細胞に侵入する準備ができたスパイクタンパク質の割合は10%未満だが、SARS-CoV-2では50%まで上昇し、アルファ株では50%以上になるという。そして感染力の強いデルタ株では、実に75%以上のスパイクタンパク質の準備が整っているという。
今後の課題
科学者たちのSARS-CoV-2の理解はまだまだ不十分である。McLellanによると、未解明の疑問の中で特に重要なのは、1個のスパイクタンパク質が宿主細胞に結合するのに必要なACE2受容体の個数や、S2サブユニットの切断部位がTMPRSS2によって切断される厳密なタイミング、それから、ウイルスと細胞膜が融合するのに必要なスパイクタンパク質の個数などであるという。これらはいずれもウイルスが細胞内に侵入する段階の話であり、その先には多くの段階がある。2020年4月には、カリフォルニア大学サンフランシスコ校(米国)のチームが、SARS-CoV-2とヒトのタンパク質との間に少なくとも332の相互作用があることを確認している25。
ウイルスの急速な変異に遅れないようにするのは容易ではない。専門家の見解は、これまでの変異のほとんどが、ウイルスが宿主に与えるダメージの大きさではなく、ウイルスが広がる効率の良さに関連したものであるという点で一致している。2021年7月に発表された研究では、デルタ株はそれ以前の株に比べて、ヒトの肺や咽喉の中で、より速く、より高いレベルで増殖すると報告されている26。
とはいえ、デルタ株の変異がウイルスをこのように変えた仕組みはまだはっきりしていないとStern-Ginossarは言う。「多くの研究機関がこの点を解明しようとしているところです」。
翻訳:三枝小夜子
Nature ダイジェスト Vol. 18 No. 10
DOI: 10.1038/ndigest.2021.211018
原文
How the coronavirus infects cells — and why Delta is so dangerous- Nature (2021-07-29) | DOI: 10.1038/d41586-021-02039-y
- Megan Scudellari
- Megan Scudellariは、米国マサチューセッツ州ボストン在住の科学ジャーナリスト。
参考文献
- Casalino, L. et al. ACS Cent. Sci. 6, 1722–1734 (2020).
- Ke, Z. et al. Nature 588, 498–502 (2020).
- Turoňová, B. et al. Science 370, 203–208 (2020).
- Nguyen, H. L. et al. J. Phys. Chem. B 124, 7336–7347 (2020).
- Shang, J. et al. Nature 581, 221–224 (2020).
- Gobeil, S. M.-C. et al. Science https://doi.org/10.1126/science.abi6226 (2021).
- Khateeb, J., Li, Y. & Zhang, H. Crit. Care 25, 244 (2021).
- Hoffmann, M. et al. Cell 181, 271–280 (2020).
- Peacock, T. P. et al. Nature Microbiol. 6, 899–909 (2021).
- Wang, M. et al. Cell Res. 30, 269–271 (2020).
- Gunst, J. D. et al. EClinicalMedicine 35, 100894 (2021).
- Finkel, Y. et al. Nature 594, 240–245 (2021).
- Schubert, K. et al. Nature Struct. Mol. Biol. 27, 959–966 (2020).
- Thoms, M. et al. Science 369, 1249–1255 (2020).
- Zhang, K. et al. Sci. Adv. 7, eabe7386 (2021).
- Blanco-Melo, D. et al. Cell 181, 1036–1045 (2020).
- Thorne, L. G. et al. Preprint at bioRxiv https://doi.org/10.1101/2021.06.06.446826 (2021).
- Braga, L. et al. Nature 594, 88–93 (2021).
- Zhang, Z. et al. Cell Death Differ. https://doi.org/10.1038/s41418-021-00782-3 (2021).
- Trimarco, J. D. et al. PLoS Pathog. 17, e1009599 (2021).
- Wolff, G. et al. Science 369, 1395–1398 (2020).
- Ghosh, S. et al. Cell 183, 1520–1535 (2020).
- Hoffmann, M., Kleine-Weber, H. & Pöhlmann, S. Mol. Cell 78, 779–784 (2020).
- Mykytyn, A. Z. et al. eLife 10, e64508 (2021).
- Gordon, D. E. et al. Nature 583, 459–468 (2020).
- Li, B. et al. Preprint at medRxiv https://doi.org/10.1101/2021.07.07.21260122 (2021).
