「ヒト胚の育成」入門編
妊娠9週目の手の神経の枝分かれを示す画像。 Credit: ILLUSTRATION: TOBY LEIGH
2013年半ば、発生生物学者Magdalena Zernicka-Goetzはある世界記録に挑戦すべく神経の張り詰めた2週間を送った。彼女はケンブリッジ大学(英国)の同僚らと、ヒト胚を実験環境でそれ以前の記録よりも長く育てようとしていたのだ。微小な細胞塊がどのようにして自己を複数の部分からなる複雑な構造に変貌させていくのかについて、手掛かりを集めたいと思ったのである。以前の試みでは受精後約1週間で発生が立ち往生してしまったが、その時点以降のヒト発生にはもっと多くの「知るべきこと」があると、Zernicka-Goetzには分かっていた。
Zernicka-Goetzのチームは、体外受精(IVF)のために準備されたが不要になって提供された胚を使って研究を開始した。過去のマウス胚研究から応用した手法を使って、特殊な培養液内に胚を浸し、定温器内に置いた。これらの試料は厳格に制御された環境に置く必要があったため、胚発生の進み具合を顕微鏡で観察できるのは1日に1〜2回のみだった。
胚発生は6日、7日、そして8日目へと進み、それらのヒト胚はまだ無事に発生し続けた1。「観察のたびに固唾をのんだものです。1日経つごとに興奮が高まっていきました」とZernicka-Goetzは当時を振り返る。最初の試みで胚発生は12日目に到達し、最終的に13日目まで延びた。「これには全く驚きました。すごくうれしかったですね」とZernicka-Goetz。
Zernicka-Goetzらのこの研究成果と、ロックフェラー大学(米国ニューヨーク)のチームに彼女が加わって出した同様のもう1つの成果2がきっかけの1つとなって、ヒト初期発生の研究はこの5年間で大いに盛り上がってきた。研究者がヒト胚を利用する機会は常に限られており、ヒト胚の初期の形態変化について分かっていることは比較的少ない。しかし今では細胞培養法の改良により、ヒト胚を体外で2週間まで育てることが可能になっている。また、CRISPRなどの遺伝子編集技術を使ったり、人工の胚様構造体を作り出したりすることで、胚の本体とその支持組織を形作る細胞シグナルや物理的な力を調べる研究も行われている。
これらの技術により、ヒト胚の着床といった重要な初期発生過程の解明も徐々に進んでいる。着床は、まだ非常に小さい胚が子宮壁に自身を定着させる過程であり、直接調べることはできないのだ。また、高解像度の新たなデジタル画像から、受精から数週間後に筋肉や神経が発生する様子が詳細に分かってきている。こうした発見によって、先天性欠損症や発生異常が起こる仕組みや、一部の妊娠が流産に至る理由の解明も進むかもしれない。
だが、これらの新しい技術は、期待をもたらすとともに、研究者らを倫理的に未知の領域へと進ませている。1970年代後半に入った頃、倫理学者や科学者の意見は、ヒト胚に関する研究を受精後2週間までに制限する「14日ルール」に収束した。この日齢は神経の最初の兆しが表れる時期であり、また、胚が分割できる最終時点でもある。国際的に認められたこの「14日ルール」は、これまでずっと、純粋に仮想上の制限だった。「誰もが突き当たる壁だからルールが作られた、というわけではありません。それが、今では技術的に可能なのです」と、ヘイスティングス・センター(米国ニューヨーク州ギャリソンにある非営利の研究所)の生命倫理学者Josephine Johnstonは話す。
ヒト胚の取扱説明書
初期胚発生の多くの過程は動物界全体を通じて驚くほど似通っており、それぞれの種で少数の遺伝子やシグナルがところどころ微調整されるくらいである。動物の中でもマウスの胚は最もよく研究されていて、分子レベルの「取扱説明書」があり、遺伝子を1個ずつ働かなくさせることでその機能が確かめられている。マウスは実験に必要な数を入手するのが容易であり、また、ヒトとマウスでは最初期の胚の細胞型や構成要素の多くがよく似ていることから、マウス胚はヒト胚発生を調べるための代理として十分だと考えられてきた。しかし現在、両者の類似性は実際にはさほどないのではないかという疑問が出始めている。「ヒト胚の初期発生を少しずつ探れるようになるにつれて、マウスとヒトの胚は似ているが同じではないことが明らかになってきたのです」と、トロント小児病院(カナダ・バンクーバー)の発生生物学者Janet Rossantは話す。
Credit: NIK SPENCER/NATURE; IMAGES:LEFT TO RIGHT: NORAH FOGARTY AND KATHY NIAKAN; MAGDALENA ZERNICKA-GOETZ GROUP; I. MARTYN ET AL./NATURE
利用できるヒト組織の供給量は限られているため、CRISPR–Cas9系などの高効率な遺伝子編集技術を使って胚発生初期を調べ始めた研究者もいる。ただし、そうした研究を実施する認可を受けた研究グループは、胚の遺伝的改変を巡る倫理的な難しさもあって、今までのところごく少数である。
フランシス・クリック研究所(英国ロンドン)の発生生物学者Kathy Niakanのチームは、この種のプロジェクトとして初めて国の規制当局から認可を受け、ヒトとマウス両方の胚性幹細胞で発現する遺伝子をCRISPR–Cas9系を使って編集した結果を2017年に報告した3。この遺伝子を破壊したヒト胚は、OCT4というタンパク質が作られず、胚盤胞(約200個の細胞からなる球状構造)になることができなかった。それと対照的にマウス胚は、この遺伝子を欠いても胚盤胞となり、それ以降になってようやく発生が停滞した(2017年12月号「ヒト胚を用いたゲノム編集研究の倫理性確保」参照)。
この研究で明らかになった違いは、発生段階のごく初期であっても、一部の遺伝学的な細部(特定の遺伝子群が活性化される時期など)はヒトに特異的なのではないかという、現在広がりつつある考え方を裏付けるものであった。「体外受精したヒト胚の大半は胚盤胞の段階まで発生できないことが分かっています」とNiakanは言う。その理由は今のところ不明だ。「ヒト胚で最初の細胞型の運命指定を担う経路を解明できれば、体外受精技術を向上させられるかもしれません」。Niakanは今後の研究で、胚盤胞のごく一部の細胞に、胎盤などの支持組織ではなく胚体になるように指示するヒト遺伝子を調べたいと考えている。
安息の場所を見つける
細胞200個からなる球状構造に育った小さな胚盤胞は、生存するために子宮壁に着床しなくてはならない。しかし、いったん着床する(受精後7日目ごろ)と、研究者がその胚の発生を調べることはほぼ不可能である。この着床過程を観察すること自体が第一の難関であり、胚発生を受精後1週間を越えて確実に維持できる方法は最近までなかった。
しかし、このブラックボックスの封印がようやく解かれた。2016年5月にZernicka-Goetzのチーム1とロックフェラー大学のAli Brivanlouのチーム2が、ヒト胚を12〜13日間発育させることのできる初めての培養系を報告したのだ。両チームは、増殖因子と栄養分を適切に混ぜ合わせた「カクテル」を使うことで、培養ヒト胚がペトリ皿の底に「着床」できることを示した。注目されるのは、それらのヒト胚が母体組織を一切必要とせずに、着床後に起こる初期の再構築段階に入ったことだ。「これは私にとって衝撃的でした」とBrivanlouは振り返る。「ヒト胚は、皿に付着してから1〜2日過ごすことも不可能だと思っていましたから」(2016年8月号「ヒト胚の体外培養で最長記録達成」参照)。
ペトリ皿に付着した胚は、実際に着床した胚よりも平たい形になる(Brivanlouはこの付着過程をパラシュートでの着陸のようだと形容する)。しかしそれでも、これらの培養ヒト胚は、動物実験や、流産その他の理由で入手されたヒト組織試料の限定的な研究から予想されるいくつかの発生段階を踏んでいった。ヒト胚がペトリ皿に付着した後、外側の細胞層は、胚の成育を支える初期の胎盤その他の細胞型に分化し始めた。内部的には、細胞は胚体(胚の本体)および卵黄嚢(胚に血液を供給する初期構造)の前駆構造へと発生するように見えた。ほぼ2週間が過ぎた後、両チームは14日ルールに従って実験を終えた。
実験終了の頃になると、一部の胚は発生が停滞していた。だが、さらに改良を加えれば、これらの培養系はヒト胚の最初の2週間をより詳細に解明するのに役立つだろうと、両研究チームは言う。
Credit: NIK SPENCER/NATURE; IMAGES:LEFT TO RIGHT: NORAH FOGARTY AND KATHY NIAKAN; MAGDALENA ZERNICKA-GOETZ GROUP; I. MARTYN ET AL./NATURE
ヒト胚は、受精後3週目になると原腸形成と呼ばれる過程に入り、いくつかの重要な出来事が起こる。胚に体軸が出来始め、一端が頭部になるよう運命付けられる。また、細胞の移動と分化が始まり、最終的に体のあらゆる器官や組織を作り出す3つの細胞層(胚葉)ができる(「ヒト胚発生の進行」参照)。この原腸形成過程の重要性が、倫理的に14日間の制限をつける主な理由の1つとなっていた。
しかし中には、代替的な手法として、ヒト幹細胞技術を使って人工的に胚様の構造体を構築している研究者もいる。この種の研究には14日ルールは適用されない。こうした構築体は、完全な胚発生に必須な特定の構成要素が欠けており、子宮に着床させたとしてもヒト個体になる可能性はないからだ。2014年、BrivanlouとEric Siggiaはロックフェラー大学の同僚らと、特別に増殖させたヒト胚性幹細胞を使って体外環境で原腸形成を模倣できたことを報告した4。幹細胞の増殖を、直径数百㎛の円形になるよう制限したところ、弓矢の的のようなパターンに分化し、そこには、将来の個体のあらゆる部分を生じる3種類の主な細胞型が含まれていることが明らかになったのだ。これらの細胞型は、扁形動物から霊長類までのほぼ全ての動物で同様の役割を持つことが分かっている。輪の中央部の細胞は皮膚や脳、神経系に、その外側の輪の細胞は筋肉、血液、骨やさまざまな器官に、そのさらに外側の輪にある細胞は消化管や呼吸器系になる。
これらの細胞でできた平たい輪は、実際のヒト胚で形成される立体的な3層構造とは見た目が異なっていたが、細胞や分子のレベルでは研究者らが期待した通りのものだった。「この系から、シグナル伝達経路と細胞運命の関係を実際に解き明かすことができます」と、博士研究員としてSiggiaの研究室に以前いたAryeh Warmflashは話す。
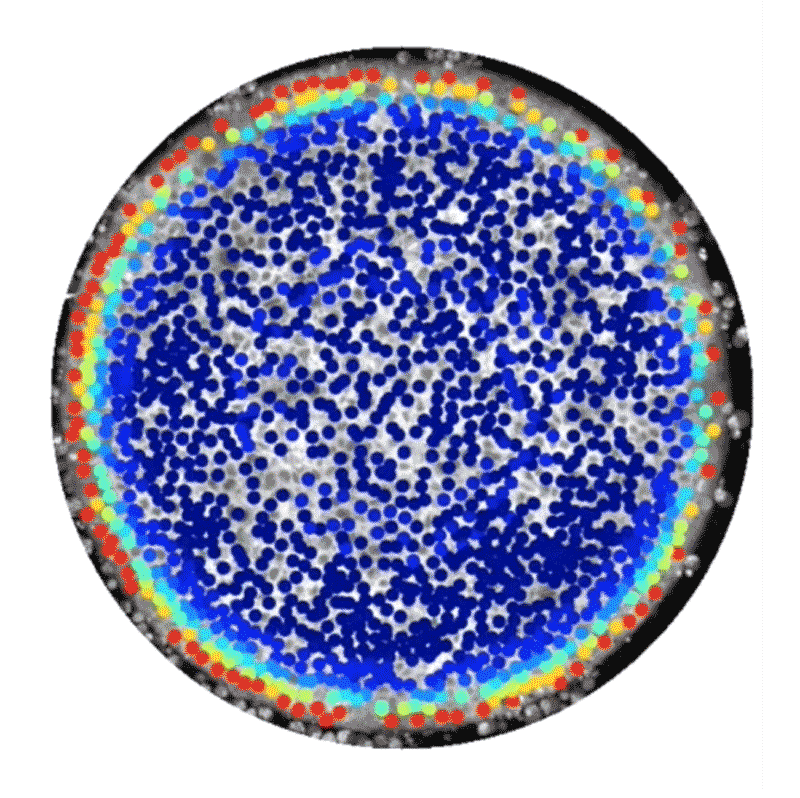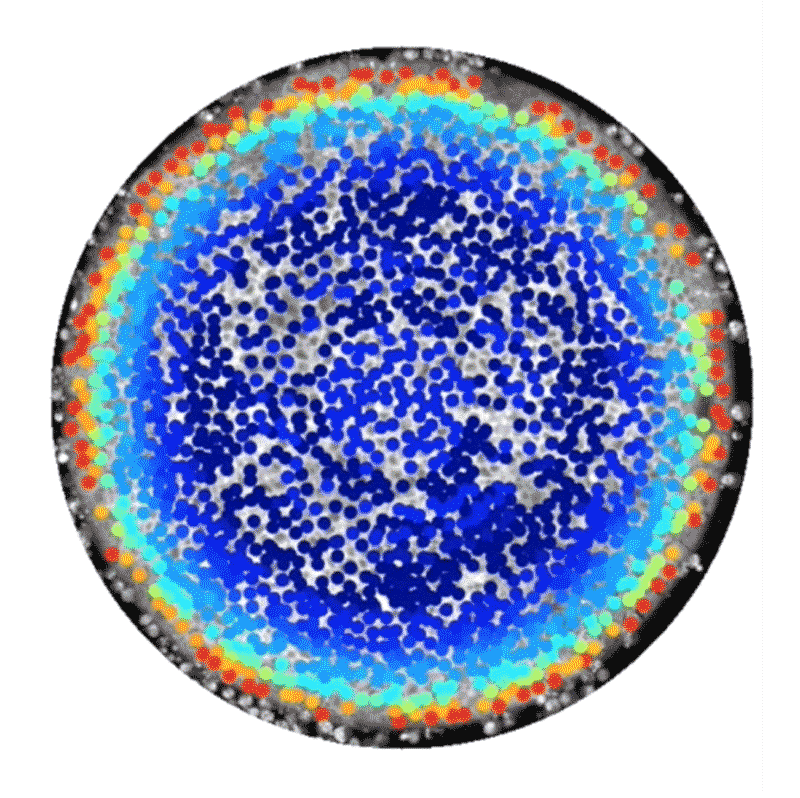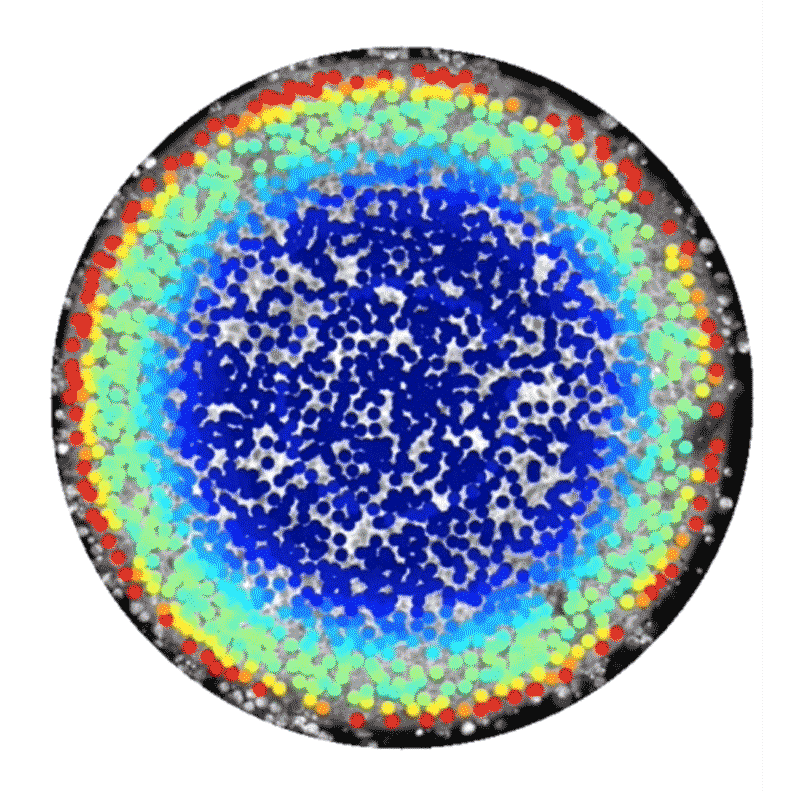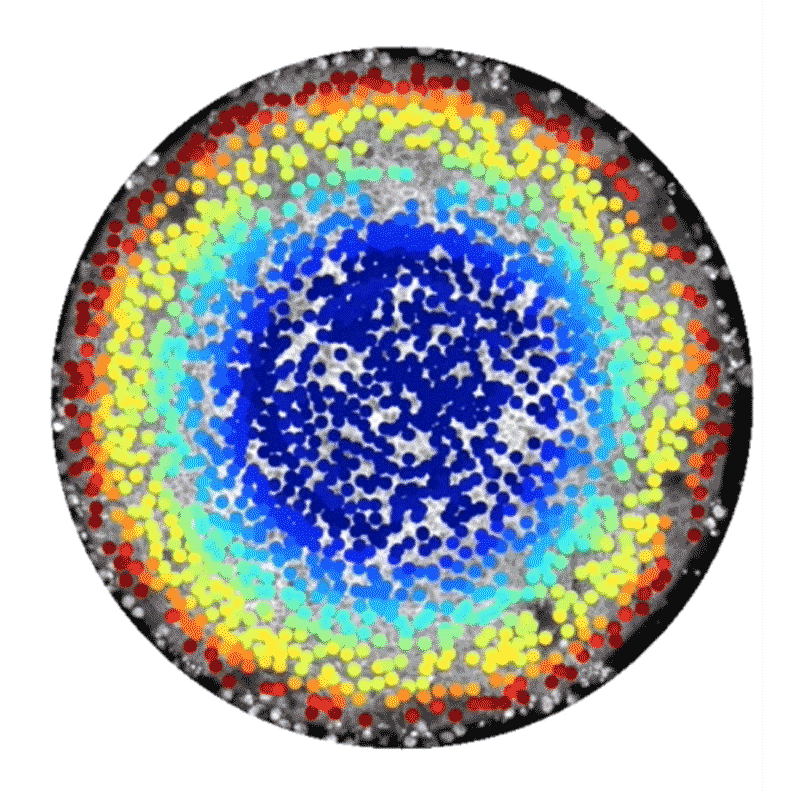
Credit: Idse Heemskerk and Aryeh Warmflash, Rice University
この系の追跡研究からすでに、胚性細胞が構造情報や化学情報を利用して異なる組織型へと自己組織化する仕組みについて詳細な新情報が得られている。2016年にBrivanlouとSiggiaのチームは、幹細胞が円形コロニー内における自身の位置を知ることができ、それに応じて増殖因子と呼ばれる分子への反応の仕方を調整し、異なる細胞ゾーンを形成するのに役立てていることを明らかにした5。また、ライス大学(米国テキサス州ヒューストン)のWarmflashのチームは2017年にbioRxivに投稿したプレプリントで、胚の自己組織化には増殖因子群の動態も関わっていることを示した6。この研究では、Nodal経路と総称される特定のタンパク質群によるシグナル伝達の急増現象が、細胞コロニーの辺縁部から内側へ波のように伝わり、その通過の跡にさまざまな型の細胞が残されることが観察された。
Brivanlouのチームはこの系をもう一歩踏み込んで利用し、2018年5月に、ある組み合わせの増殖因子群でこの種のコロニーを処理することで、「形成体」細胞の形成が誘導されることを示した7。動物の胚では、形成体の細胞が近隣細胞に指示を出して頭尾方向の体軸を形成させる。しかし「14日ルール」のせいもあって、形成体細胞が実際に機能しているところが観察されたことはなかった。Brivanlouは、ヒト胚を使った研究の倫理的・技術的な制約を踏まえて、ヒト形成体部域と思われる細胞塊を発生中のニワトリ胚に移植し、それらの移植ヒト細胞がニワトリ細胞を第二の神経系へと発生させることを観察した(2018年7月号「ヒト形成体の存在をニワトリ胚を使って確認」参照)。
生命の維持
ヒトの初期胚発生に関する多くの研究は胚そのものに目を向けているが、胚が生存し続けるには他に多くの組織が不可欠である。それらの中には、胚を包む羊膜嚢や、胚に酸素や栄養素を供給する胎盤が含まれる。
羊膜嚢の出来方をよく調べるために、ヒト幹細胞を使ったモデルが作り出された。2017年、ミシガン大学アナーバー校(米国)の発生生物学者Deborah Gumucioと生体工学者Jianping Fuのチームは、ヒト幹細胞をジェルのベッドで増殖させて、それらを天然の足場分子で取り囲んだところ、細胞群が自己組織化して羊膜嚢に似た構造になったことを報告した8。約24時間経つと1個の小孔が開き、その後、細胞群は片側に平たくなり始め、別の側には長く伸び始めた。これらは原腸形成に至る過程の特徴だ。
このモデルではヒト胚の本体と羊膜嚢のみが再現されており、生存のために必要と思われる他の支持組織は皆無だ。それでもGumucioとFuのチームは、この非対称な構造体の生成に関与する分子シグナルのいくつかを特定することができた。「この状態で情報がこれほど十分に得られるのなら、このモデルをわざわざ胚に近づける必要はないでしょう」とGumucioは話す。彼のチームは、培養したこの胚様構造体を最大5日間維持し(発生的に9〜14日目にほぼ相当)、そこで実験を終了させた。
Zernicka-Goetzらは現在、もっと胚に近い構造体を作り出そうとしている。2017年、彼女のチームは2種類のマウス幹細胞(胚そのものを作る幹細胞と、胎盤の形成を助ける栄養芽層幹細胞)を組み合わせて培養した。この人工構造体を立体的な足場に埋め込んだところ、着床後の胚に似た構造に育った9。チームは現在、ヒト幹細胞を使ってマウスの場合と同じような胚様構造体を作ることに取り組んでいる。こうした技術の開発は、胚性組織と胎盤などの胚体外組織とのクロストークを詳しく調べるのに役立つだろう。
一部の研究室では、こうした人工的な高度の胚様モデル(胚様体〔embryoid〕と呼ばれる)を開発しており、それに伴って倫理的な疑問も生じ始めている。「これは実際にはグレーゾーンに入ると思います。発生中のこれらの構造体をどう見なせばいいでしょうか」と話すのは、ジャクソン研究所(米国メイン州バーハーバー)の幹細胞生物学者Martin Peraだ。倫理学者や科学者の多くは、現在作られている人工胚は単純すぎて「14日ルール」を適用するほどではないと考えている。しかし、ケース・ウェスタン・リザーブ大学(米国オハイオ州クリーブランド)の生命倫理学者Insoo Hyunは、胚様体にどのような特徴があれば本物の胚と遜色がないといえるか、その判断基準を明確にすることがまず難題だと話す。「可能性としては、構造体が14日目をはるかに越えて存続するとか、子宮に着床させた場合に発育できるなどの特徴が考えられます」。
体を作り上げる
後期の胚発生についても詳細な解明が進んでいる。こちらの進展の多くは組織染色法や画像化技術の進歩のおかげである。2016年にアムステルダム大学学術医療センター(オランダ)の研究チームはScienceで、カーネギー科学研究所(米国ワシントンD.C.)が保管する組織コレクションに含まれる1万5000点の切片標本をデジタル化したことを報告した10。この組織コレクションには流産や外科手術、解剖で得られた試料が含まれており、収集は1880年代に始まり20世紀前半にわたって継続された。このオランダチームの成果は、ヒト発生の最初の2カ月間が対象であり、個々の切片標本で最大150器官の輪郭をデジタル的にトレースした後、元の胚の3Dモデルを再構築したもので、双方向性アトラスとして利用可能である。
この高解像度のヒト胚データを調べた研究チームは、すでにいくつかの発見を報告している。例えば、発生中に上行すると考えられていた腎臓と下行すると考えられていた生殖腺は、脊椎骨と比較して異なる速度で成長するせいで、体内を上行したり下行したりするように見えるだけであることが明らかになった10。

Credit: Alain Chédotal/Morgane Belle/Fondation
しかし、このカーネギー・コレクションには分子マーカーがないという重大な限界があり、そのため異なる細胞型を区別することは難しい。この問題に取り組むため、INSERM(フランス・パリ)のAlain Chédotalは2017年に、発生6〜14週目のヒト胚・胎児36体の新しい3Dアトラスを公表した11。Chédotalのチームは顕微鏡で撮像しやすくするために、提供された検体に組織透明化技術を使い、染色をして各種の細胞型が分かるようにした。
その結果得られた3D画像は、発生中の神経や筋肉、肺その他の器官を高解像度で詳細に示している。「細部に至るという点では過去に例のないほどでした」とハワード大学医学系大学院(米国ワシントンD.C.)のRui Diogoは話す。彼は、このデータセットを利用して四肢の筋肉の発生の仕方に関する情報を探している。
Diogoのチームは、手や足の筋肉の多くが発生途中で消失したり融合したりすることを観察した(結果は未発表)。「ヒト胚には、成人期にはない筋肉があるのです」と彼は話す。他に意外な知見の1つとして、神経の全体的な組織化は左右の手で似ているが細かい分枝パターンは左右で異なっており、分枝は受精後7〜11週で異なる経路に沿って進んでいくことをChédotalらが報告している。
発育途上の領域
研究者らは、技術を洗練させ改善しながら、ヒトの発生に関する情報をもっと得たり、妊娠損失や出生異常の原因解明に役立てたりしたいと思っている。
ヒト胚の最も初期の段階が明らかになっていくにつれて、倫理的な制限に関する議論も高まっていく。Zernicka-GoetzやBrivanlouの胚発生延長実験によって、14日ルールの是非を見直すべき時機が来たと考える人々が出てきた。2018年5月、ライス大学ベイカー健康・生命科学研究センター(米国)は、14日ルールを変更するかどうか、またどのように変更するかを議論するために、米国の科学者や倫理学者、その他の専門家(BrivanlouやJohnstonを含む)を30人集めて会合を開いた。「私は、14日ルールをこのまま維持し、例外を認めてもらうために特別な申請をするという形式がいいと思います」と、この会合にも参加したHyunは話す。
各国の規制状況
12カ国(濃い青)では、研究目的のヒト胚体外培養は14日以内と法律で定められている。他の5カ国(薄い青)では、国内の科学者が順守すべきとされる諸ガイドラインに14日以内と記されている。また、国際幹細胞学会(ISSCR)が発行する研究者向けのガイドラインにも「14日ルール」が明記されている。 Credit: NATURE 533, 169–171 (2016)
ヒト胚発生の研究成果が蓄積されるのに伴って、その技術的進歩に対する強い興味と不安の入り混じった気持ちが研究者らの間に生まれている。どちらも重要な反応だとJohnstonは言う。「そうした戸惑いや畏怖の気持ちは、胚がヒトとして最も初期の存在であることや、多くの人々が胚発生研究に道徳上の懸念を抱く理由を再認識させてくれます。これがただ単にペトリ皿に載った細胞数個の塊ではないことを気付かせてくれるのです」と彼女は話す。
翻訳:船田晶子
Nature ダイジェスト Vol. 15 No. 10
DOI: 10.1038/ndigest.2018.181020
原文
The labs growing human embryos for longer than ever before- Nature (2018-07-04) | DOI: 10.1038/d41586-018-05586-z
- Helen Shen
- Helen Shenは、米国カリフォルニア州サニーベールに活動拠点を置く科学ジャーナリスト。
参考文献
- Shahbazi, M. N. et al. Nature Cell Biol. 18, 700–708 (2016).
- Deglincerti, A. et al. Nature 533, 251–254 (2016).
- Fogarty, N. M. E. et al. Nature 550, 67–73 (2017).
- Warmflash, A., Sorre, B., Etoc, F., Siggia, E. D. & Brivanlou, A. H. Nature Meth. 11, 847–854 (2014).
- Etoc, F. et al. Dev. Cell 39, 302–315 (2016).
- Heemskerk, I. et al. Preprint at bioRxiv https://doi.org/10.1101/202366 (2017).
- Martyn, I., Kanno, T. Y., Ruzo, A., Siggia, E. D. & Brivanlou, A. H. Nature 558, 132–135 (2018).
- Shao, Y. et al. Nature Commun. 8, 208 (2017).
- Harrison, S. E., Sozen, B., Christodoulou, N., Kyprianou, C. & Zernicka-Goetz, M. Science 356, eaal1810 (2017).
- de Bakker, B. S. et al. Science 354, aag0053 (2016).
- Belle, M. et al. Cell 169, 161–173.e12 (2017).
